1. Introducción.
La investigación de los principios inmediatos en heces debe de realizarse a nivel macroscópico y miscroscópico. En primer lugar se realiza un análisis a simple vista donde observaremos su consistencia, color, olor y forma; además de buscar trozos de carne, fragmentos de fécula, grasas neutras, moco, pus y sangre que puedan darnos indicios de anormalidad en la digestión (en este momento también se podrían ver la presencia de parásitos).
A continuación se realiza un análisis microscópico mediante diferentes reactivos adicionados y la visualización por microscopía a 10x y 40x.
Además, realizaremos un test de sangre oculta en heces (SOH) para detectar sangre en heces. La presencia de la misma puede ser signo de cáncer colorrectal u otros problemas, tales como pólipos o úlceras.
Por otro lado, también llevaremos a cabo la reacción de Fehling por la cual se detectará la presencia de azúcares reductores en heces.
2. Materiales.
- Cápsula de porcelana.
- Espátula.
- Portaobjetos y cubreobjetos.
- Microscopio óptico.
- Mechero Bunsen.
- Lugol.
- Sudán III.
- Sudán III con ácido acético.
- Agua destilada.
- Muestra de heces.
- Kit de SOH.
- Pipeta Pasteur.
- Pinzas de madera.
- Tubo de ensayo de 20 ml apróx.
- HCl.
- Reactivo de Benedit.
3. Procedimiento.
Test de sangre oculta en heces (SOH)
 Abrimos la muestra de heces y dejamos su tapón boca arriba fuera del área de trabajo. Con agilidad desenroscamos el tapón unido al muestreador del tubo e introducimos su extremo en puntos diferentes de la muestra. Lo sacamos e introducimos en el vial, cerramos la muestra inicial y agitamos el vial para que se homogeneice la suspensión.
Abrimos la muestra de heces y dejamos su tapón boca arriba fuera del área de trabajo. Con agilidad desenroscamos el tapón unido al muestreador del tubo e introducimos su extremo en puntos diferentes de la muestra. Lo sacamos e introducimos en el vial, cerramos la muestra inicial y agitamos el vial para que se homogeneice la suspensión.
Seguidamente extraemos la placa del sobre y la colocamos sobre una superficie plana donde dispensaremos 5 gotas de la solución de extracción en la ventana circular marcada con una S. Esperamos 5 minutos a que aparezcan los resultados.
Análisis macro y microscópico.
En una cápsula de vidrio depositamos una pequeña cantidad de heces (como un grano de arroz o un guisante) de la anterior muestra. Añadimos también la misma cantidad de agua destilada, que mezclaremos con la misma espátula.
Tomamos una gota de la papilla y la dejamos caer en 4 portas distintos etiquetados como 'En fresco', 'Sudán III', 'Sudán III+Ac. Acético' y ' Lugol'.
Además, en cada portaobjetos depositaremos una gota de su respectivo reactivo. Finalizamos la preparación colocando el cubreobjetos y llevando a hervir la preparación de Sudán III y calentando la de ácido acético+Sudán III en el mechero Bunsen.
Reacción de Fehling.
La reacción de
4. Observaciones.
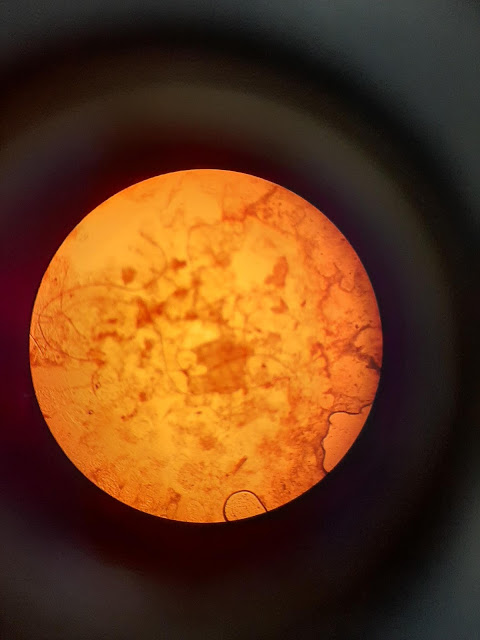
En fresco.
Sudán III.
 Se pueden observar algunos glóbulos teñidos de rojo indicativos de la presencia de grasas neutras y ácidos grasos.
Se pueden observar algunos glóbulos teñidos de rojo indicativos de la presencia de grasas neutras y ácidos grasos.También aquí observamos pelos vegetales.
Posible placa.

Tejido celular vegetal.
Ninguna evidencia de un exceso de placas y agujas finas por presencia de jabones.
Lugol.
Tampoco es observable ningún color azul-violáceo o negro que nos indique mala digestión de hidratos de carbono, así como fibras musculares mal digeridas.
Estaremos atentos a que los objetivos del microscopio no topen con el
mismo. El exceso de presión podrá romper el portaobjetos y echar a perder la
práctica, además de provocar posibles fisuras en la lente del objetivo.
Atenderemos al riesgo eléctrico de la toma de corriente del microscopio
evitando que entren en contacto las manos o conductores eléctricos
directamente con la toma. También evitaremos usarlo con las manos
mojadas, sobre todo en la operación de enchufe y desenchufe, o la entrada
de agua al sistema eléctrico.
No ingerir ni tocar ninguna parte de la cara cuando se estén utilizando los
colorantes.
Prestar especial atención a la hora de secar y/o fijar con el mechero Bunsen,
teniendo en cuenta que ningún reactivo inflamable ni objeto cualquiera se
encuentre cerca. Cuando terminemos de usarlo, nos cercioraremos de que
está bien cerrado y no hay escape de gas.
Tampoco es observable ningún color azul-violáceo o negro que nos indique mala digestión de hidratos de carbono, así como fibras musculares mal digeridas.